研究テーマ
1997年に体細胞クローン羊のドリーが報告され、分化した体細胞核が全能性を再獲得できることが示された。2006年には、体細胞に特定の転写因子を導入することにより、多能性を有する幹細胞としてiPS細胞が樹立され、再生医療への応用が期待されている。しかし、自然生殖による全能性の再獲得の効率は、クローン胚やiPS細胞による初期化と比べて圧倒的に高く、初期発生における全能性の再獲得の分子機構の解明は、効率よく体細胞核を初期化する方法の開発につながるという観点からも極めて重要である。当研究室では、哺乳類の着床前胚の発生過程および体細胞核初期化過程で生じる様々な現象について、その分子機構の解明を目指している。
(1)受精後の全能性再獲得の分子機構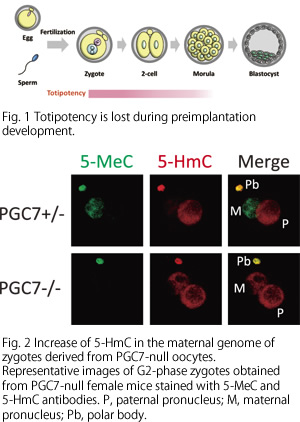
精子と卵子は次世代に遺伝情報を伝えるために存在する分化細胞であるが、受精を経て「全能性」と呼ばれる体を構成する全ての細胞に分化する能力を再獲得する(Fig.1)。我々は、全能性を有する受精卵から卵割期の間に特異的あるいは高発現する遺伝子群の同定に成功している。現在、ノックアウトマウスを用いて候補遺伝子が全能性の獲得に重要であるかどうかを検討している。
(2)受精卵におけるエピジェネティックリプログラミング機構
受精後の核内では、精子と卵子に由来するクロマチンのエピジェネティックな情報が、初期胚型に書き換えられる。我々は、受精後に、雄性ゲノムに存在する5-メチル化シトシン(5-MeC)が5-ヒドロキシメチル化シトシン(5-HmC)に変換されることを発見した。また、雌性ゲノムに存在する5-MeCは、生殖細胞特異的に発現するPGC7(Stella、Dppa3)により5-HmCへの変換が阻害されていることを見出した(Fig.2)。最近、受精卵の雄性クロマチンに特異的なヒストン修飾も見出しており、受精後のリプログラミングへの関与についても検討している。
(3)体細胞核リプログラミング機構
体細胞の核が初期化される過程において、塩基配列の変化を伴わない遺伝子発現の制御(エピジェネティック制御)が重要な役割を果たしていることが明らかとなってきている。我々は、ES細胞と体細胞を融合細胞する際にセリンスレオニンキナーゼであるAktを活性化することにより、体細胞核リプログラミングが亢進することを見出している。今後、ES細胞と体細胞の融合だけではなく、iPS細胞やクローン胚の解析を通じて、体細胞核リプログラミング機構の解明を目指している。
