主な研究内容
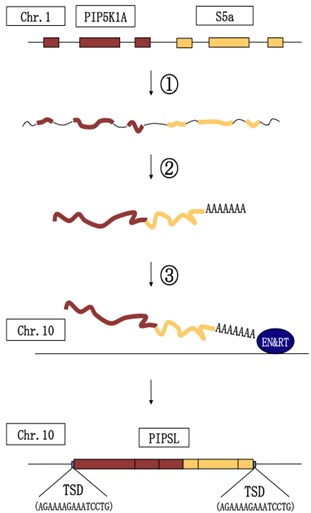 |
PIPSLは、RNAを介してエキソンが混成し、それに遺伝子重複が連動するという、極めて新奇なメカニズムで誕生した霊長類特異的な遺伝子です (左図、研究成果:論文15、17)。チンパンジーの精巣では、PIPSLのRNAからタンパク質への翻訳が抑制されています。 新たに誕生した遺伝子が、どのように発現調節機構を獲得、あるいは変化させたのか、大学院生の松村研哉さんと共に探り、最も初期にヒトと分かれたヒト科霊長類のテナガザルで、PIPSLが転写されていることを突き止めました (研究成果:論文6)。その結果、各霊長類で、共通の転写調節機構がおよそ2000万年も維持されていることが判明しました。 PIPSLの生成機構(左図) ①1番染色体上に近接して存在する2つの遺伝子のうち、上流側遺伝子の転写終結点が読み過ごされてひと繋がりのRNAが転写され、 ②2遺伝子をまたぐスプライシングの結果、コドンの読み枠を保持したキメラRNAが生じ、 ③キメラRNAのポリA配列をレトロトランスポゾンの一種であるL1の転移機構が認識し、キメラRNAを鋳型とした逆転写反応とゲノムへの挿入が行われたと考えられます。 |
|---|
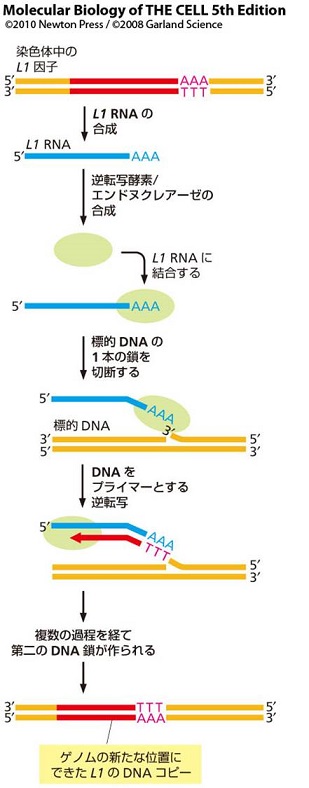 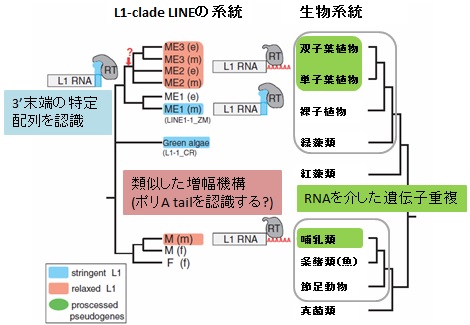 |
遺伝子重複は遺伝子進化の中核的な過程です。その一種であるRNAを介した遺伝子重複は、さまざまな真核生物で観察されていますが、分子的メカニズムはほとんど理解されていません。哺乳類では、多くの場合、特定のレトロトランスポゾン(LINEに属するL1)が関与すると考えられています。LINEは、DNA鎖の一方に生じた切れ目(3' OH)を逆転写反応開始のプライマーに用います (TPRT: Target Primed Reverse Transcription; 左図上)。 哺乳類のLINEであるL1の逆転写酵素は、TPRTを開始する際に、鋳型RNAのポリA配列を認識するという、他のLINEには無い奇妙な性質を有しています (一般にはLINE RNA 3' 領域の特定配列を認識します)。この性質のために、L1は自身のコピーを量産するだけでなく、普通の遺伝子のmRNA(3'末にポリA配列があります)も逆転写し、cDNAをゲノムに挿入して、哺乳類ゲノムに大量に存在する重複遺伝子を生じたと考えられます。 私たちは以前、被子植物のLINEにも哺乳類のL1に似た性質があり、それが植物におけるRNAを介した遺伝子重複の原動力となっている可能性を指摘する論文を発表しました (研究成果:論文13)。その様な性質は、植物と哺乳類で独立に生じた可能性が高いと考えています (左図下)。 植物に存在する哺乳類型LINEの起源を明らかにするため、次世代シークエンサを用いて基部被子植物のゲノムを解読するなどして、植物に存在する哺乳類型LINEのさまざまな性質を分析することを目指しています。 LINEの逆転写開始機構(左図上) 植物と哺乳類のLINEの平行進化(左図下) |
|---|
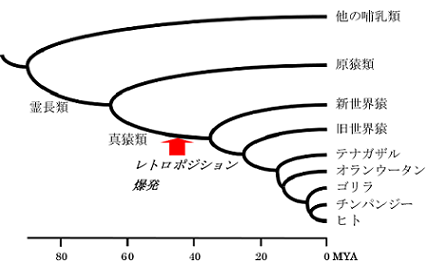 |
以前の研究で、プロセシング済み偽遺伝子をヒトゲノムから網羅的に抽出し、様々な解析を行いました (研究成果:論文20)。プロセシング済み偽遺伝子の塩基置換の程度から、生成年代を推定したところ、霊長類進化のある時期ヒトの祖先のゲノムで、プロセシング済み偽遺伝子が爆発的に増幅した可能性が示されました (左図)。現在、様々な霊長類のゲノムに存在するプロセシング済み偽遺伝子の種分岐相同関係を解析し、データベース化しています。そのデータを用いることで、ヒトプロセシング済み偽遺伝子の生成時期を精密に決定することが可能になります。 プロセシング済み偽遺伝子とAlu SINEの爆発的増幅(左図) |
|---|
